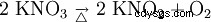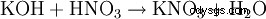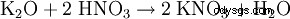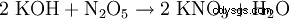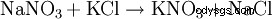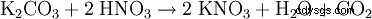| 结构式 | |||||||
|---|---|---|---|---|---|---|---|
| K | |||||||
| 常规 | |||||||
| 名字 | 硝酸钾 | ||||||
| 其他名称 |
| ||||||
| 分子式 | KNO3 | ||||||
| CAS号 | 7757-79-1 | ||||||
| 简短说明 | 白色结晶性粉末 | ||||||
| 属性 | |||||||
| 摩尔质量 | 101.11 克摩尔 | ||||||
| 物质状态 | 固定 | ||||||
| 密度 | 2.109 g cm (16 °C) | ||||||
| 熔点 | 334 °C | ||||||
| 沸点 | 分解>400 °C | ||||||
| 溶解度 | 在水中良好(20°C 时为 316 g/L),在非极性溶剂中较差 | ||||||
| 安全说明 | |||||||
| |||||||
| 在可能和常见的情况下,使用 SI 单位。除非另有说明,否则给出的数据适用于标准条件。 | |||||||
硝酸钾 , 俗称Saltpeter , 特别是 硝酸钾 , 是硝酸的钾盐。
属性
硝酸钾形成无色晶体,遇冷溶于水。因此,它在温水中比在冷水中更容易溶解。 0°C 时 1 升水中最多可溶解 130g 硝酸钾,100°C 时 1 升水中最多可溶解 2455g 硝酸钾。在如此高的浓度下,溶液的密度明显大于纯水。
硝酸钾受热分解为亚硝酸钾和氧气:
在高温下它是一种极好的氧化剂。玻璃器皿中烧焦的残渣很快溶解在熔融的硝酸钾中。
硝酸钾的吸湿性明显低于许多其他硝酸盐,例如硝酸钾。 B. 硝酸钠。
提取
- 自然现象
硝酸钾(最少“Nitrokalit”)在土壤中以风化形式出现。中国和东南亚的矿床具有重要的经济意义,在 19 世纪上半叶,每年通过浸出这些土壤可提取 10,000 多吨硝石。
- 富氮有机废弃物的细菌硝化 从14世纪末到19世纪,硝石是在细菌和大气氧气的帮助下在欧洲生产的,以便独立于进口这种用于战争目的不可缺少的原料。 (见“历史”)。富含氮的有机废物(粪便和尿液)与石灰和木灰(钾碱)混合,然后在松散、透气的土堆中分解。氮化合物被细菌转化为硝酸盐。两年后,该物质被水浸出。将钾碱添加到原料碱液中,从而将硝酸钙和硝酸镁转化为硝酸钾和难溶的碱土金属碳酸盐。将过滤后的碱液蒸发得到硝酸钾,再通过重结晶提纯。
- 转化硝石
从19世纪中叶到1920年前后,智利硝酸盐与氯化钾的转化是生产硝酸钾的最重要工艺:NaNO3 + KCl --> KNO3 + NaCl
这里使用氯化钠溶解度随温度略有增加:KNO3的母液 -加热前一个循环中的结晶并以化学计量比加入粗硝酸钠和氯化钾。在100°C下通过添加少量苏打来浓缩混合物,在此期间氯化钠和杂质(碱土金属碳酸盐)沉淀并过滤掉。滤液再次用蒸发的冷凝液稀释,以避免冷却过程中钠盐沉淀,过滤澄清,然后冷却至5°C以结晶硝酸钾并离心。分离的硝酸钾出于技术目的进行重结晶。
- 硝酸合成
今天,硝酸钾是合成生产的(见Representation )。
外观(工艺)
硝酸钾的表示方式有很多种:
- 几乎所有的盐形成反应:
- 来自碳酸钾:
用法
- 硝酸钾用于食品保鲜(固化盐 E 252)
- 用于生产黑色火药和其他烟火混合物
- 24% 硼 + 71% KNO3 的混合物 + 5% 的粘合剂 (PMMA) 是一种可靠的点火混合物,在极低的温度 (-196°C) 下也能燃烧。
- 60% NaNO3 的混合物 +40% 硝酸钾3 熔点为 222°C,用作太阳能热电厂的传热介质。这种熔盐在高达 590 °C 的温度下具有化学稳定性,具有 1.55 kJ/(kg K) 的高比热容,1.79 g/cm³ 的密度,并且与水一样薄(粘度:2.1 mPa s)。它很容易润湿金属表面,如果结构和材料选择不合适,可能会导致密封问题。不锈钢在很大程度上耐硝酸盐熔体(侵蚀速率:6 - 15 µm / 年,在 570 °C)。湍流管处的传热系数约为 6000 W/K m²。由于其高热容量 (2.8 MJ/(K m³)),硝石熔体也适合作为储热介质。通过添加亚硝酸钠可以进一步降低熔化温度。一种 53% KNO3 的盐混合物,称为 HiTec + 40% NaNO2 + 7% NaNO3 在 140°C 时熔化,如果与亚硝酸钠的毒性无关,它作为传热介质具有特别有利的特性。
- 硝石浴用于对镁含量高达 10% 的变形铝合金进行热处理。熔盐的最高允许温度取决于镁的含量;它从 0.5% Mg 时的 550°C 降至 10% Mg 时的 380°C。
- 在烟雾弹中
- 在肥料中
历史
早在 11 世纪,Marcus Graecus 的书中就提到了硝石,该书中还首次提到了黑色粉末混合物,作为一种从泥土和石头上刮下来的新物质。 Hassan ar-Rammah (Al-Furusiyya wa al-Manasib al-Harbiyya 所著的 13 世纪晚期关于骑马战斗和战争机器使用的书 ) 已经包含了一些关于用木灰清洁硝石和制备燃烧装置和火箭燃料的规定。
硝石最初是从印度进口的;威尼斯从中间贸易中获得了高额利润。随着需求的增加和独立的原因,从 14 世纪末开始,政府通过“硝石政权”通过严厉的法律促进了自己的硝石生产,并通过严厉的法律确保了生产、进口和使用的所有权利。由于氧气的快速释放,硝石是火药中硫和木炭突然燃烧的基础,因此作为一种长期稀缺的物质,是六个世纪以来的战略原料。
在图林根,16 世纪有九个硝石厂。布拉格附近的伏尔塔瓦河岸上布满了“卫生凳”,哈雷市授予了从垃圾场提取硝石的特许权。硝石日益增长的需求部分通过进一步进口(主要来自印度)和自有工厂来满足。
从 14 世纪末开始,硝石园得到了系统的栽培。动物排泄物(粪便、粪便、尿液和血液)充满石灰质泥土、来自墓地或屠宰场或沼泽的泥土,以及石灰、瓦砾和灰烬在坑中或堆积起来,偶尔倒入液体肥料或尿液。一两年后,分解产生了如此多的硝石,以至于它可以从地球上冲走。产量约为6:1,即从6公斤的硝酸土中得到1公斤的硝石。
硝石锅炉作为一个特殊且非常冷门的职业,被允许随时进入物业,在那里寻找硝石。即使对于 17 世纪和 18 世纪的教堂也是如此,不包括敬拜时间。在瑞典,农民甚至不得不用硝石缴纳部分税款。
在 19 世纪,甚至发生了一场硝酸盐战争,智利对其邻国发动了这场战争,以独占沙漠中巨大的硝酸钠矿床(“Caliche”),现在可以立即用钾盐将其转化为硝酸钾。从 1916 年起,这一转化过程最终被 Haber-Bosch 工艺所取代,该工艺从空气和水中生成氨,然后转化为硝酸。
来源
- ↑ 关于硝酸钾的条目 在 BGIA 的 GESTIS 物质数据库中,检索于 2007 年 9 月 3 日 (需要 JavaScript)
参考文献
- Perry, R.H.,Chemical Engineers' Handbook,第 4 版,McGraw-Hill Book Company,纽约,1963 年,第 9-77 页
- Janz,GH 等人,与储能 II 相关的物理特性数据汇编。熔盐,NSRDS,1979 年 4 月
- Gartz,J,爆炸物文化史,E.S.Mittler &Son,汉堡,2006 年