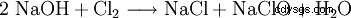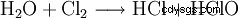| 结构式 | ||||||||
|---|---|---|---|---|---|---|---|---|
 | ||||||||
| 常规 | ||||||||
| 名字 | 次氯酸钠 | |||||||
| 其他名称 | 次氯酸钠、次氯酸钠、次氯酸钠、L'eau de Labarraque/Eau de Javel(水溶液) | |||||||
| 分子式 | NaOCl | |||||||
| CAS号 | 7681-52-9 | |||||||
| 简短说明 | 黄色固体,带有难闻的甜味 | |||||||
| 属性 | ||||||||
| 摩尔质量 | 74.44 克摩尔 | |||||||
| 物质状态 | 固定 | |||||||
| 密度 | 1.2 g cm (13% 游离氯溶液) | |||||||
| 熔点 | 24.5 °C(五水合物) | |||||||
| 蒸气压 | 23 hPa (20 °C) | |||||||
| 溶解度 | 在水中良好(0 °C 时为 293 g/L,23 °C 时为 942 g/L,各五水合物) | |||||||
| 安全说明 | ||||||||
| ||||||||
| WGK | 2 – 对水有害 | |||||||
| 在可能和常见的情况下,使用 SI 单位。除非另有说明,否则给出的数据适用于标准条件。 | ||||||||
次氯酸钠 (NaOCl) 是次氯酸(也称为次氯酸)的钠盐 (HClO)。它是一种白色粉末,通常每摩尔次氯酸钠含有 6 摩尔结晶水。次氯酸钠水溶液的通用名称是Eau de Labarraque 或 Eau de Javel , 标签 Eau de Javel 是完全不正确的。这是指次氯酸钾溶液,可能与其他盐如氯化钾混合;但是,它通常是不被区分的。
获取/表示
次氯酸钠是通过在烧碱中通入氯气或电解氯化钠溶液制得的。
该反应引起重大的技术问题。因为它形式上是氯的水解,根据
随着生成的盐酸或次氯酸的随后中和,很容易看出这些反应的反应焓导致强烈的加热,所有次氯酸盐都对其敏感。事实上,同样的化学过程也用于制造氯酸盐,只不过是在热溶液中进行反应。出于这个原因,所有工业次氯酸盐都含有不同的,有时是大量的氯酸盐。生产过程中产生的次氯酸盐与氯反应最终生成氯酸盐。
用法
使用目的是漂白或消毒(例如在游泳池中)。在游泳池中使用并非没有问题,因为给药量必须足以将存在的氨(或胺)氯化到超过一氯胺的水平,因为只有这样才能保证充分的消毒。
次氯酸钠也是消毒和漂白家用清洁剂(如 DanKlorix 等)的主要活性成分。各种除霉剂也含有这种活性成分。
次氯酸钠也用于牙科。例如,用于细菌感染牙齿的根管治疗,对牙齿进行消毒。
安全说明
处理次氯酸钠时需要格外小心!当次氯酸钠与多种物质和物质组(包括还原剂、胺、甲酸、甲醇、有机物质和其他一些物质)发生反应时,存在爆炸的危险。吸入时强烈攻击黏膜。
此外,次氯酸钠与酸(如盐酸、硝酸)和氧化剂(如过氧化氢、高锰酸盐)反应有时非常剧烈,产生热量并释放氯气和/或亚硝气。
单独的热量或阳光会导致次氯酸钠分解,释放出氯、氯化氢、二氧化氯和氧气等。储存物质时也必须考虑到这一点。
来源
- ↑ BGIA GESTIS 物质数据库:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 5 月 12 日。 2007