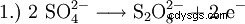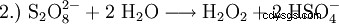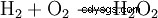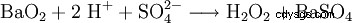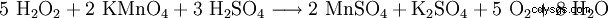| 结构式 | ||||||||
|---|---|---|---|---|---|---|---|---|
| 常规 | ||||||||
| 名字 | 过氧化氢 | |||||||
| 其他名称 | μ-1κO,2κO'-dioxidedihydrogen, perhydrol, 双氧水(废弃) | |||||||
| 分子式 | H2 O2 | |||||||
| CAS号 | 7722-84-1(水溶液) | |||||||
| 简短说明 | 无色液体 | |||||||
| 属性 | ||||||||
| 摩尔质量 | 34.02 克摩尔 | |||||||
| 物质状态 | 液体 | |||||||
| 密度 | 1.45 g cm(20 °C,纯) 1.11 g cm(20 °C,30%) | |||||||
| 熔点 | -0.41 °C(纯) -33 °C (35%) -11 °C (90%) | |||||||
| 沸点 | 150.2 °C(纯) 108 °C(35%) 142 °C(90%,分解) | |||||||
| 蒸气压 | 1.9hPa (20°C) | |||||||
| 溶解度 | 与水完全混溶 | |||||||
| 安全说明 | ||||||||
| ||||||||
| MAK | 0.5 ml m 或 0.71 mg m | |||||||
| 在可能和常见的情况下,使用 SI 单位。除非另有说明,否则给出的数据适用于标准条件。 | ||||||||
过氧化氢 (H2 O2 ) 是一种淡蓝色、高度稳定的氢气和氧气的液体化合物,稀释后无色。它比水稍微粘稠,是一种弱酸,对大多数物质来说是一种非常强的氧化剂,因此会与诸如B. 铜、黄铜、碘化钾发生反应,因此充当强漂白剂和消毒剂。在高度浓缩的情况下,它既可以用作单一的火箭推进剂,也可以用作组分火箭推进剂。
物理性质
H2 O2 -分子弯曲(二面角 =111°)。由于通过氢键的强交联,纯过氧化氢非常粘稠。由于高度浓缩(=几乎无水)H2 O2 不稳定且自发分解成爆炸,尤其是与金属接触时,通常以最高 35% 的水溶液形式在非处方药出售。然而,对于工业需要,也有 50% H2 的浓度 O2 在水中。
接触超过 20% 的过氧化氢溶液会导致化学灼伤。因此在处理时必须戴上防护手套。
制造
过去,过氧化氢主要是通过硫酸电解生产。生成过氧二硫酸,再水解成硫酸和过氧化氢。
今天,过氧化氢在技术上是使用蒽醌法生产的。为此,蒽氢醌与大气中的氧气在压力下反应,形成过氧化氢和蒽醌。下一步可将蒽醌再用氢气还原为蒽氢醌等。总方程式为:
在实验室规模上,在用酸处理过氧化物时也会产生过氧化氢。历史上一种重要的试剂是过氧化钡,它在硫酸溶液中反应生成过氧化氢和硫酸钡。
摩尔生成焓为:
- Δf H气体 :-136.11 kJ/mol
- Δf Hliq :-188 kJ/mol
- Δf H溶胶 :-200 kJ/mol
化学性质
过氧化氢倾向于分解成水和氧气。这释放出98.02 kJ/mol的能量:
-
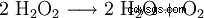
- 两分子过氧化氢歧化为水和氧气。
这种分解反应由 Mn(见证明)或其他重金属离子、I 和 OH 离子等催化。因此 H2 O2 - 市售溶液与稳定剂(包括磷酸)混合。它是一种强氧化剂。当氧化态从-I降低到-II时,仅形成水和氧作为反应产物。没有难以分离或破坏的副产物,简化了其在实验室中的使用。
还可以作为还原剂对抗强氧化剂(如高锰酸钾)。
过氧化氢是一种非常弱的酸;其无机盐和有机酯为氢过氧化物和过氧化物。
证明
对于定性检测,Mn 离子(例如 MnSO4 ) 承认。如果产生气体,则使用阴燃芯片测试来检查氧气。如果结果是正的,因为发光芯片发光,H2 是 O2 现在。
- 检测为过氧化铬(CrO(O2 )2 )
从节日彩排中制作。三氧化铬CrO3 在强酸性范围内(pH <0)使用过氧化氢会产生深蓝色的过氧化铬,它溶于乙醚。为此,将重铬酸钾与稀释的 H2 所以4 酸化并用 1 cm 乙醚覆盖(扣除!),加入样品并摇匀。醚相变蓝。
- 检测为过氧钛(IV)离子([Ti(O2 )OH])
用“钛黄”(不要与同名染料混淆)进行检测是一种非常灵敏的检测。 (无色)钛 (IV) 离子,即使含有微量的过氧化氢,也会产生强烈的橙黄色过氧钛离子。反之,也可以用过氧化氢对一种物质进行钛(IV)的检测。
- 用高锰酸钾检测
测定水溶液中的浓度,例如B.漂白浴。用n/10高锰酸钾溶液的硫酸溶液进行血氧饱和度测定(变为永久淡粉色(持续约1分钟)),按下式进行:
生理学
过氧化氢具有很强的腐蚀性,特别是作为蒸气。如果您的皮肤上有过氧化氢,您应该用水(稀释)彻底冲洗该区域,或至少立即将其从皮肤上去除。它迅速杀死皮肤细胞,然后变白。
总的来说,过氧化氢具有细胞毒作用,而且由于对许多原核微生物有很强的毒性,因此具有消毒作用。
过氧化氢在许多生化过程中形成。在生物循环中,它是通过糖的氧化代谢形成的。有机体借助酶(过氧化氢酶、过氧化物酶)保护自身免受毒性作用,这些酶将其转化为无毒的 O2 和 H2 分解O。
一个精子受精后,雌性卵细胞会短暂产生低浓度的过氧化氢杀死其他精子。
此外,过氧化氢是诱导植物防御病原体(细胞毒性方面)的信号分子。
用法
漂白剂
过氧化氢是一种漂白剂,因此在化妆品中用于漂白头发和美白牙齿。常用作与尿素结合的过氧化物。
- 白金金发,最大程度避免发色,人类归功于过氧化氢。这种极易反应的液体会破坏头发中的色素。
在世界范围内,最大的应用是纸浆的环保漂白。纸浆是从木材和它所含的木质素与 H2 获得的 O2 漂白。纸浆的主要用途是制造纸、餐巾、手帕等。
在手工艺品中,过氧化氢用于漂白 - 即使木材变亮,例如木材。 B. 在修复或翻新期间。
过氧化氢或含有过氧化氢的漂白剂,例如过氧乙酸和过氧化氢的混合物,也用于广告中,带有人造词 活性氧 调用。
消毒杀菌
为了消毒,过氧化氢作为 3% 的溶液用于口腔和咽喉,例如B. 牙科;它还用于对隐形眼镜清洁剂中的隐形眼镜进行消毒,对包装材料进行消毒,以及对手进行消毒。它还用于面部护肤霜,以打开毛孔,对抗粉刺和瑕疵。常用于工业废水的净化和游泳池水的消毒。
在食品工业中,30%的过氧化氢用于无菌灌装系统对PET瓶进行灭菌,许多食品(饮料、牛奶、乳制品、酱汁、汤等)都采用纸盒、杯子、瓶子和箔纸进行无菌包装,以提高保质期和产品质量。最常用的工艺是使用浓缩过氧化氢 (35%) 进行灭菌。 H2的高杀菌效果 O2 、环境相容性和良好的技术可行性是该工艺得到广泛应用的原因。在操作实践中,喷雾和浸浴工艺是有区别的。
氧气输送
过氧化氢可用于水族箱中以供应氧气。氧气在氧化剂中产生。为此,在催化剂的帮助下,过氧化氢在水族箱中的容器中分解成水和氧自由基。
同时使用多种效果
在装修内饰时,过氧化氢可用于对抗霉菌生长。作为消毒剂,它既能杀死生物活性细胞(杀菌剂),又能破坏孢子(杀孢子)。它也不能用作漂白剂 去除覆盖物的残留物 - 白色多孔表面 - “光学无害”。过氧化氢比酒精或次氯酸钠更可取,因为这些物质是副产品,例如B. 底土中可以产生盐类。与过氧化氢相比,酒精既不杀孢子也不漂白。
过氧化氢也用于骨骼制备过程中的漂白和消毒。在牙科中,H2 O2 用于牙齿组织的局部消毒和轻微干预时的止血。
在农业上,过氧化氢用于温室消毒和水培培养基充氧。
生物学
为了确定细菌培养物,使用 3% 过氧化氢溶液进行过氧化氢酶测试。大多数需氧菌和兼性厌氧菌以及真菌都具有过氧化氢酶,能够分解对细胞有毒的 H2 O2 分裂。
过氧化氢可用于法医检测血液。 1818 年 Louis Jacques Thenard 发现血红蛋白中的过氧化物酶分解过氧化氢。 Christian Friedrich Schönbein 于 1863 年以此为基础开发了一种验血方法。然而,今天,更灵敏的 Kastle-Meyer 测试被用于检测血液。
实验上,过氧化氢在生物学上被用于在分离的真核细胞中诱导程序性细胞死亡。
焦散
在微电子学中,硫酸和过氧化氢的混合物——称为“piranha”——用于清洁晶圆表面,并在晶圆上形成一层约 3-4 nm 厚的亲水氧化层。如今,术语“SPM”(过氧化硫混合物)更为常见。主要应用是去除光刻胶。
在印刷电路板 (PCB) 的制造中,使用氯化铜蚀刻液去除铜:
-
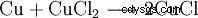 。
。 - 元素铜与氯化铜 (II) 反应生成氯化铜 (I)。这是一个比例。
双氧水与盐酸一起使用再生氯化铜蚀刻液:
-
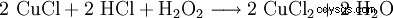 。
。 - 氯化铜(II) 通过氯化铜(I) 与过氧化氢和盐酸反应再生。铜原子被氧化了。
过氧化氢和盐酸的加入是通过氧化还原电位来控制的。
火箭/鱼雷发动机
作为能源和氧气的供应商(例如通过二氧化锰分解),它以浓缩形式用于火箭驱动器(例如:Max Valier、Messerschmitt Me 163)和潜艇驱动器(Walter U-Boot)。在高锰酸钾的帮助下分解的过氧化氢也被用作 A4 燃油泵(500 马力)的推进剂。未分解的过氧化氢在英国火箭(例如黑箭)中用作氧载体,在常温下为液体,并在那里与煤油一起燃烧。
过氧化氢往往会不受控制地分解。所以于 1934 年 7 月 16 日去世。 Kurt Wahmke 和两名技术人员在 Kummersdorf 观看由过氧化氢驱动的发动机爆炸。由于使用和处理的危险(腐蚀作用、不受控制的分解、如果罐和管道系统被污染会爆炸),现在仅限于小型火箭发动机(记录尝试、控制发动机)。
俄罗斯核潜艇库尔斯克的沉没 2000年有传言是由于过氧化氢从鱼雷中的油箱泄漏,然后与铜部件发生反应,导致鱼雷破裂。
炸药制造
在合适的催化剂存在下,过氧化氢与丙酮反应形成过氧化丙酮。过氧化丙酮是一种爆炸物,但由于处理起来非常不安全,因此未在商业上使用。更准确地说,过氧化丙酮也称为三过氧化三丙酮,缩写为 TATP。其他用过氧化氢制成的炸药包括六亚甲基三过氧化二胺(HMTD)。
据弗劳恩霍夫化学技术研究所的专家称,TATP 被用于以色列的大多数自杀式爆炸事件。据说 2005 年 7 月 7 日对伦敦地铁的袭击(55 人死亡)也是由 TATP 实施的。最后,在 2007 年 9 月 4 日,三名在巴基斯坦受训的伊斯兰主义者在绍尔兰的 Oberschledorn 被捕,他们想从 730 公斤 35% 的过氧化氢溶液中生产 TATP,以袭击美国公民经常光顾的美国设施和餐馆。
另一方面,专家并不详细了解恐怖分子如何以受控方式引爆用过氧化氢制成的 TATP。特别是 2007 年在伦敦试图将液体炸药走私到飞机上的企图遭到挫败,人们质疑是否可以使用走私的过氧化氢和丙酮瓶在飞机上生产合适的过氧化丙酮。
参考文献
- Werner R. Thiel:过氧化氢的新途径:现有工艺的替代方案? Angewandte Chemie 111(21),第 3349-3351 页 (1999)
- Heribert Offermanns、Gunther Dittrich、Norbert Steiner:过氧化氢在环境保护和合成中的作用 .我们时代的化学 34(3), pp. 150–159 (2000), ISSN 0009-2851
参考文献
- ↑ 关于过氧化氢的条目 在 BGIA 的 GESTIS 物质数据库中,于 2007 年 11 月 16 日检索 (需要 JavaScript)
- ↑ Süddeutsche Zeitung 2007 年 9 月 6 日,第 2 页:“当前百科全书:过氧化氢 “。签名:mkf
- ↑ 本段信息基于mkf 署名文章《当前百科:过氧化氢 “在Süddeutsche Zeitung第2页 从 6.9.2007 开始。
- ↑ 2007 年 9 月 6 日《南德意志报》,第 1f 页。
- ↑ netzeitung.de
- ↑ Rundschau-online.de
- ↑ 本段引用了 oraclesyndicate - Karl Weiss 和维基百科文章 Acetone Peroxide。