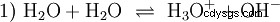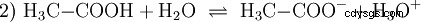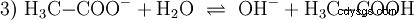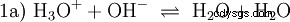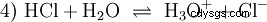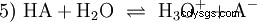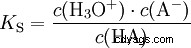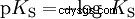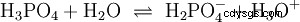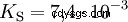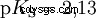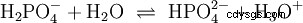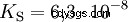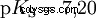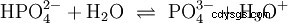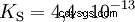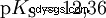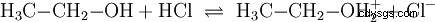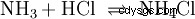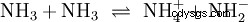酸 从狭义上讲,是所有能够将质子 (H) 转移到反应伙伴的化合物——它们可以充当质子供体。在水溶液中,反应物基本上是水。氧鎓离子 (H3 O),溶液的pH值因此降低。酸与所谓的碱反应形成水和盐。因此,碱与酸相反,能够中和酸。
从更广泛的意义上说,不同的酸碱概念描述的化学反应范围更广,远远超出上述反应范围。
酸的历史发展
可能是已知最古老的酸(lat. acidum ) 是醋 (lat. acetum ),约 5% 的复合乙酸水溶液。酸是类似醋的东西 (oxos 或 酸杆菌 )。在炼金术中,酸被认为是一种原始物质 .酸性特性基于单一 尿酸 ,它在各种物质中生效。酸会导致石灰或碳酸盐起泡,具有腐蚀性和燃烧的味道。除了醋和其他植物汁,直到 13 世纪末才知道酸。对酸的扩展知识归功于生活在 8 世纪的 Geber,但它基于更年轻的所谓 pseudo-Geber 的著作 [1]。开发了各种无机酸的知识,所有这些都是元素水的变种 被归因。从 18 世纪开始,它们被称为无机酸。
- 生产硝酸(HNO3 ) 可能在 13 世纪后被伪施者用作溶解水 (aqua dissolutiva ) 或强水 (aqua fortis ) 描述。用硝石和明矾将硫酸铜加热至赤热。亚硝酸气体逸出,与水形成硝酸。这种酸也被称为分离水 ,因为它在化学反应中溶解银而不是金。 1648 年,J. R. Glauber 描述了浓缩(发烟)硝酸(spiritus acidus nitri ) 通过与硫酸反应。
- 从今天的角度来看,王水可能是硝酸和盐酸的混合物,因为它可以通过硝酸与众所周知的氨水反应相对容易地获得。王水是所有酸的女王 ,甚至不是黄金,金属之王 ,可以抗拒。
- 亚硫酸(H2 所以3 ) 早已为人所知,因为它可以通过燃烧元素硫来获得。硫酸当然也存在于许多过程中。更详细的制备硫酸(H2 所以4 ) 由 A. Libavius 于 1597 年首次更详细地描述:a) 硫酸铁或硫酸铜与硫酸盐 (Oleum vitrioli , 发烟硫酸) 和 b) 硫的燃烧和随后的氧化产生稀溶液 (Oleum sulphuris ) 引领。 19 世纪,铅腔工艺的技术实施取得了成功。
- 盐酸(HCl)作为一种独立的化合物直到 16 世纪末才为人所知。 A. Libavius 描述了通过点燃食盐和粘土的混合物进行合成。 B. Valentinus 描述了将硫酸和食盐转化为 aqua caustica , 腐蚀性水。 J. R. Glauber 在 17 世纪的深入研究导致了 Glauber 的盐鬼 (Spiritus salis Faithrianus ) 的非常集中的,所谓的吸烟 盐酸或气体氯化氢。
17 世纪,G. E. Stahl、R. Boyle 和 GF Rouelle 等炼金术士使用了作为酸的现象学对应物的重要术语碱,因为“碱性”物质具有非挥发性 固定挥发性酸的依据 形成并可以中和酸的(腐蚀)作用。 A. L. Lavoisier 为某些化合物赋予了某些特性,在 18 世纪在化学中迈出了重要的一步。他认为酸总是由非金属氧化物和水形成,而碱则由金属氧化物和水形成。另一方面,J. von Liebig 将酸视为可以被金属转化为盐的氢化合物。
1887 年,S. Arrhenius 将酸定义为溶解在水中时释放质子 (H) 的物质,将碱定义为溶解在水中时释放氢氧根离子 (OH) 的物质。当酸和碱结合时,它们相互中和形成水。然而,该理论仍然不充分,因为不包括不含氧的化合物:氨也可以中和酸。 1923 年,J. N. Brønsted 和 T. Lowry 独立描述了今天仍然是最重要的酸和碱定义。它们构成了以下酸解释的基础。
酸的性质
- 酸尤其会腐蚀贱金属和石灰。但衣服、皮肤和眼睛(通常都是有机材料)在接触时也有风险。警告!化学灼伤总是会发生。戴安全眼镜!
- 有强酸和弱酸之分。盐酸是一种强酸。乙酸是一种较弱的酸,而碳酸是一种弱酸。
- 酸可以用水稀释,但根据稀释程度,其效果会明显减弱。稀释浓酸是放热反应。产生大量热量,酸溶液会不受控制地喷出。因此,在稀释时,将酸添加到水中的规则适用,而不是相反:“先是水,然后是酸,否则会发生可怕的事情。 “
- 酸总是液体是一个常见的谎言。众所周知的以固体形式存在的酸的代表是维生素 C 和柠檬酸。
- 酸会使蓝色石蕊试纸变红。
- “酸的对手”是碱(碱溶液 =碱液)。它们可以中和酸。碱也具有腐蚀性,会攻击许多其他不一定与酸发生反应的物质。
- 酸溶于水后会导电。这里发生电解,其中在阴极(-极)形成氢气,在阳极(+极)形成酸残基离子的中和物质(酸阴离子),例如氯盐酸。还原(接受电子)发生在阴极,氧化(失去电子)发生在阳极。
什么是酸?
不详细阐述各种酸碱概念 此处应将一种可能且常见的看待事物的方式描述为介绍。 通常与酸密切相关 并且经常没有明确提及 水的存在和某些特性。纯水会经历所谓的自质子分解。氧鎓离子 (H3) 从水中形成,数量非常少且等量 O)和氢氧根离子(OH):
这个水的反应方程式显示了酸的性质,即形成H3的能力 水中的 O 离子。同时,水中形成OH离子。基地可以具备的品质之一。但是,水既不称为碱也不称为酸,它们的行为称为中性 .这是指pH,即H3的浓度 表示水中的 O 离子。纯净水的 pH 值为 7,浓度非常低。与本节中描述的所有反应一样,该反应是一种平衡反应:离子的形成及其结合形成水以相同的频率不断发生。 中性 并不意味着什么都不会发生。
酸是可以以某种方式与水相互作用的化合物。它们具有像离子一样键合的氢原子(离子)。这就是纯乙酸(H3 C-COOH) 与水形成更多的 H3 O离子。当这种反应发生时,一种化合物可以称为酸。除氧鎓离子外,还形成乙酸根阴离子 H3 首席运营官:
与无机酸如盐酸相比,乙酸是一种羧酸,是一种相当弱的酸。在水溶液中,大部分分子未解离为 H3 C-COOH 之前。在这里,也很快建立了平衡。因此,上述反应方程式(2)可以从右到左阅读,具有相同的理由。乙酸根阴离子与氧鎓离子反应生成水和乙酸。在这个阅读方向上,会发生基本反应 取而代之的是:氢氧离子转化为水分子。如果将适量的乙酸根阴离子,例如易溶的乙酸钠形式的乙酸根阴离子加入到乙酸溶液中,则乙酸的酸性性质可以完全被乙酸根离子的碱性性质所补偿。中和水溶液。 中性 并不意味着解决方案中没有任何事情发生。只有 H3 的浓度 O 离子与纯水中一样低。
此外,基本反应 考虑,当乙酸钠是纯时发生 水溶解:
氢氧根离子 (OH) 在这里形成。向该醋酸溶液中加入适量的醋酸水溶液,使溶液变为中性 .它位于 H3 之间 O 和 OH 进入平衡 (1),最初表现为水的基本性质,并表示为等式 (1a) 的倒数。
| 酸可以理解为在水溶液中具有H3能力的化合物 形成 O 离子或将 OH 离子转化为水分子。 另一方面,碱具有在水溶液中形成 OH 离子或 H3 的能力 O到H2 哦。 |
许多被称为酸的物质从一开始就是水溶液,不能容易地理解为具有离子键合氢原子的化合物。盐酸是一种水溶液 气体氯化氢(HCl),被认为是一种强酸。在这个解决方案中——在酸的任何实际使用之前——平衡(4)已经存在,其中平衡几乎完全在右手边。
氯化氢早已耗尽其成为酸和 H3 的潜力 O 离子形成。盐酸实际应用中产生的化学效应是由于H3反应引起的 归因于 O 离子。酸是 H3 O离子。 pH 值在这里是酸度(浓度)的量度,而在弱酸(如乙酸)的情况下,酸强度的量度(pKa 值)处于前景中。强酸和弱酸在“喜欢”或“不喜欢”H3 的倾向上有所不同 在水中形成 O 离子。酸碱平衡部分更详细地描述了这些趋势。
| 酸在实际使用中的化学作用主要是对H3 O 离子回来。可以将氧鎓离子视为最重要的酸。 |
酸碱平衡
在质子分解过程中,反应物(通常是水)吸收酸释放的质子。这与发生电子转移的氧化还原反应不同。
酸HA在水溶液中的一般平衡反应 是:
酸在将 H 离子转移到水中的倾向不同。这称为酸强度 K s 表示和表示酸反应的平衡常数(酸常数)。酸度常数通常以 pK 的形式给出 s -值,定义为酸度常数的负对数。
大写K的酸 s -值(小 pK s -值)是强酸。如果含酸溶液的 pH 值低于 pK 两个单位 s 值,只有 H3 的百分之一 形成O离子。
多元酸
可以分裂出几个质子的酸称为多元酸 .硫酸(H2 所以4 ) 是二质子(也是二质子)磷酸(H3 采购订单4 ) 一种三质子(也是三质子)酸。释放单个质子(质子分解)的尝试大小不同,可以使用酸常数 (K
对于磷酸:
pKS -重要酸的值
无水酸碱反应
类似于在水溶液中发生的酸碱反应,在水的参与下,在其他介质中也会发生反应。在无水乙醇中,与氯化氢发生反应,其中乙醇起碱的作用:
在气相中,气体氨与氯化氢反应生成盐氯化铵。
除了水,其他足够极性的溶剂也可以作为酸碱反应的反应物。一个很好的例子是液氨的自质子分解:
酸的例子
重要的酸是:
- 硫酸:H2 所以4 (工业用途、酸雨)
- 盐酸:HCl(工业用)
- 磷酸:H3 采购订单4 (食品工业,包括可乐、遗传物质)
- 碳酸:H2 一氧化碳3 (食品工业、技术、氛围)
- 乙酸:CH3 COOH(食品行业)
- 氢氟酸:HF(计算机芯片制造)
- 硝酸:HNO3 (工业用途)
多元酸的盐也可以作为酸(“酸性盐”),例如
- 硫酸氢盐
- 磷酸氢盐
参考文献
酸的历史发展:
- Claus Priesner,Karin Figala:炼金术:密封科学百科全书。 贝克,慕尼黑 1998,ISBN 3406441068
- V. Karpenko,J.A. Norris:化学史上的硫酸。 Chem. Listy,第 96 卷,2002 年,页数:997-1005 [2]
- 捐助者 在大不列颠
- 酸列表
- 基地
- 酸碱概念