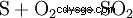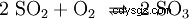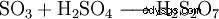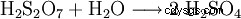| 结构式 | |||||||
|---|---|---|---|---|---|---|---|
| 常规 | |||||||
| 名字 | 硫酸 | ||||||
| 其他名称 | 硫酸(VI)酸、浓硫酸、二硫酸氢盐、一硫酸 | ||||||
| 分子式 | H2 所以4 | ||||||
| CAS号 | 7664-93-9 | ||||||
| 简短说明 | 无色无味的微粘液体 | ||||||
| 属性 | |||||||
| 摩尔质量 | 98.08 克摩尔 | ||||||
| 物质状态 | 液体 | ||||||
| 密度 | 1.8356g·cm | ||||||
| 熔点 | 10.38°C | ||||||
| 沸点 | 279.6 °C | ||||||
| 蒸气压 | 1.3 hPa (145.8 °C) | ||||||
| 溶解度 | 与水完全混溶 | ||||||
| 安全说明 | |||||||
| |||||||
| MAK | 0.1 mg m(以可吸入气溶胶分数计) | ||||||
| LD50 | 2140毫克公斤(大鼠) | ||||||
| WGK | 1 - 对水有轻微危害 | ||||||
| 在可能和常见的情况下,使用 SI 单位。除非另有说明,否则给出的数据适用于标准条件。 | |||||||
硫酸 (根据 IUPAC:硫酸二氢盐 ) 是一种无色粘稠液体,是一种强无机酸。它是一种无机酸,是化学工业中最重要的 20 种化学品之一。作为食品添加剂,编号E 513 .稀硫酸 称为稀酸。直到19世纪,硫酸还有一个俗称的浓硫酸(来源于硫酸),今天已不再使用。
硫酸的盐和酯 称为硫酸盐和硫酸氢盐。盐状硫酸盐含有硫酸根离子(SO4 )。
获取与显示
过去,硫酸是使用硫酸法和铅室法生产的。现代方法有接触法和由其发展而来的双接触法。
最古老的硫酸生产工艺是硫酸法。它在 13 世纪被炼金术士使用。硫酸盐是相对容易热分解形成三氧化硫和金属氧化物的硫酸盐。约翰·鲁道夫·格劳伯 (Johann Rudolph Glauber,1604-1670) 于 1650 年左右在诺德豪森 (Harz) 建造了世界上第一家硫酸工厂,并利用这一工艺生产硫酸。
在接触过程中,生产分三个步骤进行,从元素硫 (S) 和氧 (O2 ) 二氧化硫 (SO2 ) 显示:
二氧化硫进一步用五氧化二钒氧化(V2 O5 ) 作为催化剂,生成三氧化硫 (SO3 ) 实施:
三氧化硫是硫酸的酸酐。由于其水溶性低,它不直接加入水中,而是加入浓硫酸中,被浓硫酸很好地吸收。
生成的二硫酸不断用水稀释。
属性
分子式为H2的硫酸 所以4 是一种强酸(pK
硫酸与水形成共沸物。如果将 100% 的硫酸加热至沸腾,三氧化硫会蒸发,直至达到约 98% 重量的浓度。反之,稀硫酸可以通过煮沸达到这个浓度。
100% 的硫酸是通过将三氧化硫鼓泡到约 98%(重量)的硫酸中直至其无水而制备的。硫酸还可以结合大量的三氧化硫,产生的液体因其高粘度而被称为发烟硫酸。发烟硫酸由硫酸和多硫酸的混合物组成(二硫酸:H2 S2 O7 , 三硫酸 H2 S3 O10 等)具有高达 65%(重量)三氧化硫的发烟硫酸是可商购的。发烟硫酸用于磺化的化学反应或当需要从反应中结合尽可能多的水时。这样可以最大限度地减少硫酸的消耗,并且通常可以最大限度地提高产量。
为了确定浓度,测量硫酸的密度。因此,浓度可以直接从标准表中推导出来。例如,确定汽车电池的充电状态(另见铅酸电池)。
稀释浓硫酸时,放出大量热量。因此,必须采取适当的预防措施。重要的是始终 酸水 混入,即不是 酸的水 !否则,水会爆炸性地蒸发,导致液体不受控制地喷出;危险是显而易见的。助记符:“先是水,后是酸,否则会发生可怕的事情。”
含义及用途
硫酸是最常见的化学品之一。 1997年,全球产量超过1.3亿吨。可能的应用非常多样化。使用硫酸
- 用于消化矿石(例如在氧化钛 (IV) 或铀消化中)
- 用于生产硫酸盐
- 用于生产其他酸(例如氢氟酸或磷酸)
- 用于通过硝酸生产肥料
- 用于生产表面活性剂
- 作为催化剂
- 用于金属处理
- 作为干燥剂
- 作为反应助剂(硝化酸)
- 在汽车电池中
- 用于蚀刻半导体
- 因为它作为电解水添加剂的导电性
- 吸烟时用作溶剂
- 在分析中确定聚酰胺的粘数
- 用于生产二氧化钛
在食品工业中,硫酸用作生产变性淀粉和酪蛋白以及处理饮用水的技术添加剂。它不会流入最终产品,因此不存在或仅以对健康无害的微量存在。在欧盟,硫酸不必在产品包装上声明。
将高锰酸钾溶解在硫酸中至饱和会产生深绿色油状液体(七氧化二锰),它是一种强氧化剂。它会立即将木材等有机材料烧焦,并与丙酮或其他燃料一起自发燃烧。通过将重铬酸钾溶解在硫酸中,可以得到硫酸铬,这是过去实验室常用的一种清洁物质。
产生的硫酸量是一个国家化学工业效率的指标。化工二期开发阶段消耗大量硫酸。
开发阶段:
- 一、烧碱消费占主导地位
- 二、主要的硫酸消费量 三、现行的氯消耗量
结构与键合
在硫酸分子中,与硫酸氢阴离子一样,硫原子具有扭曲的四面体配位。与 OH 基团的两个 S-O 键明显长于两个“裸”氧原子。发现的键长对应于键序 1 和 2。然而,在常用的带有(共价)双键且没有正式电荷的符号中,如果不使用 3d 轨道,就无法解释四个氧原子与硫的键合。使用 π 键的硫(参见 PSE)。然而,详细的理论考虑表明 d 轨道对主族元素化合物中的键合贡献很小。因此,与“裸”氧原子的较短键更好地描述为共价单键,其通过额外的静电相互作用而缩短。电荷分离可以从遵循八位组规则的单一介观边界结构推导出来。
证明
硫酸可以以硫酸根阴离子的形式检测。例如,加入氯化钡溶液后沉淀为难溶性微晶硫酸钡,可作为硫酸盐检测。
重要联系
盐类:
- 硫酸铜(硫酸铜)
- 硫酸钙(石膏、雪花石膏、硬石膏)(CaSO4 )
- 硫酸钡(重晶石、重晶石)(BaSO4 )
- 明矾(铝与其他阳离子的混合硫酸盐)
- 氧化铝
- 硫酸亚铁(硫酸亚铁)
- 硫酸钠(芒硝)
酯类:
- 硫酸二甲酯(溶剂、甲基化剂;剧毒)
来源
- ↑ BGIA GESTIS 物质数据库中关于硫酸的条目,检索于 2007 年 3 月 31 日 (需要 JavaScript)
- 亚硫酸H2 所以3 (亚硫酸氢盐)
- 硫酸露点