| 结构式 | |||||||
|---|---|---|---|---|---|---|---|
| 2 Na | |||||||
| 常规 | |||||||
| 名字 | 硫酸钠 | ||||||
| 其他名称 | 硫酸二钠,E 514,芒硝(Na2 所以4 · 10H2 O) | ||||||
| 分子式 | 钠2 所以4 | ||||||
| CAS号 | 7757-82-6 | ||||||
| 简短说明 | 无色无味晶体 | ||||||
| 属性 | |||||||
| 摩尔质量 | 142.04 克摩尔 | ||||||
| 物质状态 | 固定 | ||||||
| 密度 | 2.70g cm | ||||||
| 熔点 | 884 °C | ||||||
| 沸点 | 1689 °C | ||||||
| 溶解度 | 水中良好:170 g/l,20 °C | ||||||
| 安全说明 | |||||||
| |||||||
| 在可能和常见的情况下,使用 SI 单位。除非另有说明,否则给出的数据适用于标准条件。 | |||||||
硫酸钠 (Na2 所以4 ,过时的名称硫酸钠 ) 是硫酸的钠盐,由两个钠离子 (Na) 和硫酸根阴离子 (SO4 ) 在一起。十水合物 (Na2 所以4 · 10H2 O) 在化学家 Johann Rudolph Glauber 之后也被称为 Glaubersalz 也称为卡尔斯巴德盐 是通过蒸发卡罗维发利矿泉水获得的,主要由十水硫酸钠组成,用作泻药,如芒硝。
历史
硫酸钠是由化学家和药剂师约翰·鲁道夫·格劳伯于 1655 年左右生产和描述的。他自己称他发现的盐为Sal mirabilis 和Mirabili .
获取与显示
硫酸钠很少从天然矿物中开采,因为它通常是化学工业反应的副产品,其中硫酸用苛性钠中和。技术代表的另一种可能性是岩盐(NaCl)与硫酸反应以获得盐酸,硫酸钠作为副产物(800°C):
-
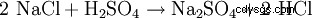
- 氯化钠和硫酸反应生成硫酸钠和氯化氢。
实验室可通过以下反应制备硫酸钠:
-

- 钠和硫酸反应生成硫酸钠和氢气。
-
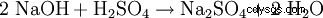
- 烧碱与硫酸中和的过程中会产生硫酸钠和水。
属性
无水硫酸钠在 884°C 熔化,具有吸湿性,加热时易溶于水(溶液热)。相反,由于所谓的熵效应,十水合物在强冷却下溶解。十水硫酸钠是许多矿泉水的成分,从 32 °C 左右开始在其自身的结晶水中缓慢融化。溶液中析出无水盐,无水硫酸钠过饱和。
用法
硫酸钠在洗涤剂中用作填料,在医药中用作泻药,用于纸浆生产(硫酸盐工艺)以及玻璃、纺织和油漆工业。实验室使用退火的无水硫酸钠干燥有机溶剂。十水硫酸钠(芒硝 ) 用作泻药和潜热蓄热材料。
在食品技术中,用作固化剂、酸度调节剂和载体物质。硫酸钠和硫酸氢钠是欧盟编号为E 514的食品添加剂 没有最大限制(quantum satis ) 一般批准用于食品。
来源
- ↑ https://www.zusatzstoffe-online.de/zusatzstoffe/216.e514_natriumsulfate.html
