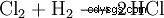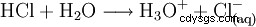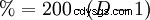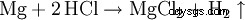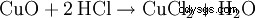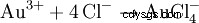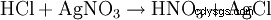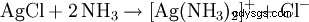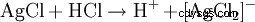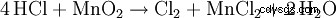| 结构式 | |||||||
|---|---|---|---|---|---|---|---|
| 没有可用的结构式 | |||||||
| 常规 | |||||||
| 名字 | 盐酸 | ||||||
| 其他名称 |
| ||||||
| 分子式 | 不适用 | ||||||
| CAS号 | 7647-01-0 | ||||||
| 简短说明 | 无色至淡黄色液体,有刺激性气味 | ||||||
| 属性 | |||||||
| 摩尔质量 | 不适用 | ||||||
| 物质状态 | 液体 | ||||||
| 密度 | 1.19 g cm(37% 溶液) | ||||||
| 熔点 | -35 °C(36% 溶液) | ||||||
| 沸点 | 57 °C(36% 溶液) | ||||||
| 蒸气压 | 127 hPa(20 °C,36% 溶液) | ||||||
| 溶解度 | 氯化氢可溶于水,浓度可达37% | ||||||
| 安全说明 | |||||||
| |||||||
| MAK | 2 毫升 m 或 3.0 毫克 m | ||||||
| WGK | 1 - 对水有轻微危害 | ||||||
| 在可能和常见的情况下,使用 SI 单位。除非另有说明,否则给出的数据适用于标准条件。 | |||||||
盐酸 (系统名称盐酸 ) 是气体氯化氢(化学式 HCl)的水溶液。它是一种强无机酸,是一种无机酸。盐酸的盐称为氯化物。最著名的氯化物是氯化钠(NaCl,食盐)。
历史
最早的炼金术士一定知道盐酸。他们的发现归功于 1 世纪的 Maria Prophetissa 和 9 世纪的 Geber。
早在 15 世纪上半叶,Basilius Valentinus 就通过石盐(岩盐)与硫酸铁反应获得了盐酸。约翰·鲁道夫·格劳伯在 17 世纪成功地用食盐和硫酸生产了它。拉瓦锡称为盐酸acide muriatique (纬度。 muria =盐水)。盐水泉仍被称为Muriatic泉 指定的。在北美,盐酸也被称为盐酸 调用。
出现次数
在自然界中,盐酸存在于火山气体和火山口湖的稀释溶液中。它以游离形式存在于脊椎动物的胃液中(按质量计为 0.1 至 0.5%)。盐酸盐的沉积物几乎取之不尽,如岩盐,溶于海水。
获取与显示
盐酸是实验室用浓硫酸和食盐生产的(因此得名):
硫酸将氯化氢从其盐中置换出来,尽管氯化氢是更强的酸。这是可能的,因为氯化氢是气态的,实际上不溶于硫酸。结果,氯化氢不断地从平衡中消失。生成的硫酸盐是硫酸氢钠,一种酸性盐。
在化学工业中,通过燃烧氯气引爆气体(氢气和氯气的混合物)获得高纯度氯化氢。
为完成酸化,将氯化氢气体溶解在水中:
工业纯盐酸主要是有机化合物氯化的副产物。
属性
| % HCl | g HCl/l | 摩尔浓度 | 密度 |
|---|---|---|---|
| 10.5 | 110 | 3.06 | 1,050 |
| 15.5 | 166 | 4.61 | 1,075 |
| 20.4 | 224 | 6,22 | 1,100 |
| 22,3 | 248 | 6.89 | 1,110 |
| 24,3 | 272 | 7.56 | 1,120 |
| 26,2 | 296 | 8,22 | 1,130 |
| 28,2 | 321 | 8.92 | 1,140 |
| 30,1 | 347 | 9.64 | 1,150 |
| 32,1 | 372 | 10,23 | 1,160 |
| 34,2 | 400 | 11,11 | 1,170 |
| 36,2 | 428 | 11.89 | 1,180 |
| 38,3 | 456 | 12.67 | 1,190 |
| 40,4 | 485 | 13,47 | 1,200 |
在 0 °C 时,HCl 气体很好地溶解在水中(如果水仍处于液相中)(815 克或 507 升/升)。这会产生热量。在 25 °C 时,一升饱和盐酸含有 825 g HCl (42.7%)。溶液的密度为 1.20 g cm。密度的浓度依赖性显示在相邻的表中。 HCl 的密度和百分比含量之间存在随机数学联系:小数点后两位对应浓度,例如B. 1.10 g cm是20%盐酸的密度。
HCl含量大于36%(重量)的盐酸也称为发烟盐酸 表示是因为在敞开的容器上形成了白雾。
纯盐酸可蒸发,不留残渣。如果加热 HCl 含量超过 20%(重量)的盐酸,则逸出的 HCl 比水多,直到剩下 20% 的 HCl 和 80% 的水的混合物,这就是所谓的共沸物。 1013 mbar共沸物中HCl的准确含量为20.17%,沸点为110 ℃。
HCl 在水中完全解离,浓盐酸 (32%) 的 pH 值为 -1。在潮湿空气中,HCl气体会形成细小的盐酸雾。
稀盐酸是电的良导体。
反应
盐酸溶解大多数金属,但贵金属除外,例如钽(锗)、铜和汞(仅在氧气存在的情况下)和银形成氯化物和氢气,除非受到钝化保护。
由于金属氧化物与盐酸反应生成氯化物和水,因此非常适合快速去除钢材上的锈迹:
盐酸和硝酸的混合物被称为王水,因为它还可以溶解“金属之王”黄金。除了亚硝酰氯和初生氯的氧化作用外,通过络合物形成降低有效金离子浓度也有贡献:
用法
盐酸作为一种无机酸在化学工业中具有重要意义。例如,盐酸用于矿石和磷酸盐的加工。用于油气井的酸处理,以及用于酸洗、蚀刻和焊接的金属加工。
盐酸是化学分析中的重要试剂。它能够通过沉淀将一组金属与其他金属分离。然后可以单独进一步分析这些(参见:盐酸组)。碱度法是盐酸的另一个应用领域。
作为食品添加剂,盐酸的名称为E 507。
生物学重要性
在人类和动物中,盐酸是胃液的一种成分,它会引起脂肪的水解等作用,还可以在细菌进入进一步的消化系统之前将其杀死。
安全说明
与皮肤接触会导致化学灼伤。蒸气有刺激性。如接触眼睛,请立即用大量清水冲洗并就医。如果发生事故或感到不适,请立即就医。
证明
盐酸一方面是通过其酸性特征来检测的。此外,通过与氯化银形式的硝酸银沉淀,在高度稀释的溶液中鉴定出氯阴离子:
生成的白色沉淀溶于氨水或浓盐酸中形成络合物:
如果在二氧化锰存在下加热盐酸,会产生氯气:
盐酸的百分比含量通过用苛性钠滴定来确定(→ 酸度法,体积分析)。这种测定以及氯化物的测定可以使用氯苯酸的汞盐进行光度测定。胃液中盐酸含量的测定采用Günzburg试剂。
参考资料
- ↑ BGIA GESTIS 物质数据库中关于盐酸的条目,2007 年 12 月 16 日检索 (需要 JavaScript)
- ↑ Nils Wiberg、Egon Wiberg、Arnold Fr. Holleman:无机化学教科书 , 第 101 版, p.460f., Gruyter 1995, ISBN 978-3-11-012641-9