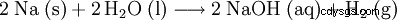| 结构式 | |||||||
|---|---|---|---|---|---|---|---|
| 常规 | |||||||
| 名字 | 氢氧化钠 | ||||||
| 其他名称 | 烧碱、烧碱、烧碱、皂石、氢氧化钠、氢氧化钠、烧碱(水溶液)、E 524 | ||||||
| 分子式 | 氢氧化钠 | ||||||
| CAS号 | 1310-73-2 | ||||||
| 简短说明 | 白色结晶固体,常呈颗粒状 | ||||||
| 属性 | |||||||
| 摩尔质量 | 39.997 克摩尔 | ||||||
| 物质状态 | 固定 | ||||||
| 密度 | 2,130 克厘米 | ||||||
| 熔点 | 322°C | ||||||
| 沸点 | 1388°C | ||||||
| 蒸气压 | 13帕(618℃) | ||||||
| 溶解度 |
易溶于水: | ||||||
| 安全说明 | |||||||
| |||||||
| MAK | 未指定 | ||||||
| WGK | 1 – 对水有轻微危害 | ||||||
| 在可能和常见的情况下,使用 SI 单位。除非另有说明,否则给出的数据适用于标准条件。 | |||||||
氢氧化钠 (还有烧碱 , 烧碱 ), 化学式 NaOH , 是一种白色吸湿性固体。它溶于水并产生大量热量,生成强碱性苛性钠(c =1 mol/l 时 pH 值约为 14)。它与空气中的二氧化碳反应形成碳酸钠,因此储存在密闭容器中。为防止氢氧化钠与空气中的水分结合,可与干燥剂一起存放。作为一种强碱,它可以从盐中取代较弱和更易挥发的碱。
2001年世界产量为4600万吨。
制造
- 碳酸钠与氢氧化钙反应生成氢氧化钠和碳酸钙:
过滤掉微溶的碳酸钙。易溶的氢氧化钠残留在滤液中。
- 将氯化钠电解成烧碱、氢气和氯气(氯碱电解)。
有几个工业过程:
- 合并程序
- 隔膜程序
- 膜过程
(另见氯碱电解)
所有工艺的共同点是额外的纯化和浓缩步骤,以获得无水氢氧化钠。
- 氢氧化钠可以在实验室通过元素钠与水反应生成苛性钠和氢气来获得:
- 烧碱蒸发后,残留固体氢氧化钠:
用法
- 生产各种肥皂(烧碱)
- 染料生产(烧碱)
- 利用木材和稻草生产纤维素
- 丝光棉
- 油脂、油和石油清洁
- 铝土矿消化(铝生产中的前体)
- 各种化学品的合成(例如次氯酸钠、磷酸钠、硫化钠、铝酸钠)
- 甲酸的合成
- 软化水的生产:离子交换剂的再生
- 电子产品中裸露印刷电路板材料的开发(20°C 时约为 10g/l)
- 下水道清洁剂的一部分
- 为棕色和“肥皂味”制作椒盐卷饼
- 用于实验室和水族馆需求的去离子器的再生
- 为模型制造商蚀刻黄铜、镍银和铜板
- 使用蓝色碱液测定葡萄酒的酸度
- 清洁不锈钢罐
- 去除旧漆(剥离)
- 用于拉直卷曲的头发(松弛剂)
- Natron 机车
- 检测所有有机氮化合物(“Manute 检测”)
- 在工业加工过程中去除水果和蔬菜的皮(!)
- 淬火剂溶解在水中用于硬化钢
实验例子
如果在水中加入少许氢氧化钠,然后搅拌,溶液会升温。例如,这适合作为在学校使用的放热溶液过程的简单示例。将硝酸钾或硝酸铵溶解在水中时会观察到相反的效果,即吸热溶解过程,而溶解硝酸铵时效果要强得多(温度降低约10 K)。
来源
- ↑ BGIA GESTIS 物质数据库:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 2007 年 2 月 15 日
- 钠