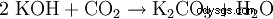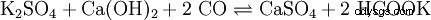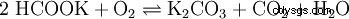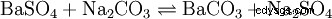| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| 2 K | |||||||
| Allgemeines | |||||||
| 名字 | 碳酸钾 | ||||||
| 安德烈·纳曼 |
| ||||||
| 总结形式 | K | ||||||
| CAS 编号 | 584-08-7 | ||||||
| 库兹贝施雷布恩 | weißes, kristallines Pulver | ||||||
| Eigenschaften | |||||||
| 摩尔质量 | 138,20 g·mol | ||||||
| 集合体 | 节日 | ||||||
| 说辞 | 2,428 克·厘米 | ||||||
| Schmelzpunkt | 891 °C | ||||||
| 西德朋克 | Zersetzung | ||||||
| 失恋 | Wasser 中的 sehr gut (1120 g/l),酒精中的 unlöslich | ||||||
| 安全感 | |||||||
| |||||||
| 马克 | 麦凯因 | ||||||
| WGK | 1 | ||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet。 Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen。 | |||||||
碳酸钾 (Pottasche ), K
Verhalten
在 Wasser ist es sehr leicht und gut löslich (1120 g/l) 中。 Durch Hydrolyse reagiert die Lösung wegen der Bildung von Kaliumhydroxid 碱:
-
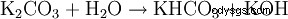 。
。 - Kaliumcarbonat reagiert mit Wasser zu Kaliumhydrogencarbonat und Kaliumhydroxid.
Mit Säuren entstehen unter Kohlendioxidentwicklung die entsprechenden Kaliumsalze。 Bei Raumtemperatur kristallisiert es als Dihydrat aus der wässrigen Lösung。
前锋
- 在 einigen Binnengewässern(Totes Meer,Wüste Lop Nor)
- in einigen kleineren Lagerstätten
格温农
Kaliumcarbonat lässt sich nicht wie Natriumcarbonat nach dem Ammoniak-Soda-Verfahren gewinnen, das Zwischenprodukt Kaliumhydrogencarbonat (KHCO3 ) zu gut löslich ist.
- Carbonisierung von Kalilauge:
- 阿尔斯 CO2 -Quelle nutzt man überwiegend Verbrennungsgase。
- Reaktion von Kalkmilch (Calciumhydroxid-Lösung) mit Kaliumsulfat und Kohlenmonoxid bei 30 bar (Formiatverfahren)。 Das abgetrennte Kaliumformiat wird anschließend oxidativ calciniert:
- Auslaugen von Pflanzenasche und anschließendes Eindampfen(历史、技术 keine Bedeutung mehr)
验证
- Herstellung von Schmierseifen
- Düngemittel für saure Böden
- Herstellung von Kaligläsern
- Herstellung von Farben
- Herstellung von fotografischen Entwicklern
- wasserfreies Kaliumcarbonat wird im Laborbereich auch als Trocknungsmittel eingesetzt。
- Triebmittel für Flachgebäck(“Plätzchen”,besonders Weihnachtsbäckerei)和 Teigen mit hohem Zuckergehalt。
- Behandlung von Kakao
- Neutralisationsmittel bei der Verwendung von Salzsäure (E 507) als 'Aromaverstärker'。
- Schnelltrocknung von Rosinen:Durch Entfernen der natürlichen Wachsschicht der Trauben verdunstet die Feuchtigkeit leichter。
- als Ausgangsprodukt für andere Kaliumverbindungen。
- Zum Entfernen von Asche aus Töpfen (1 Essl. auf die Kruste im Topf geben, über Nacht stehen lassen und am nächsten Tag mit einer Tasse Wasser aufkochen:die Rückstände lösen sich flockig vom Topfboden)
- Trennmittel für Gipsabgüsse (Bildhauerei)
- Schmelzcarbonatbrennstoffzellen 的 Elektrolytbestandteil
- Zusatzstoff für die Einnahme von bestimmten Suchtmitteln
Soda-Pottasche-Aufschluss
Der Soda-Pottasche-Aufschluss wird für schwerlösliche (Erdalkali-)Sulfate, hochgeglühte (saure oder amphotere) Oxide, Silicate und Ag-Halogenide verwendet; der Aufschluss findet in einer Na2 一氧化碳3 /K
Ein Beispiel für Sulfate:
奎伦
- ↑ Eintrag zu 碳酸钾 在 der GESTIS-Stoffdatenbank des BGIA,abgerufen am 24.8.2007 (JavaScript erforderlich)