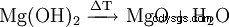| 结构式 | |||||||
|---|---|---|---|---|---|---|---|
| 没有可用的结构式 | |||||||
| 常规 | |||||||
| 名字 | 氢氧化镁 | ||||||
| 其他名称 | 氢氧化镁(II),水镁石,E528 | ||||||
| 分子式 | Mg(OH)2 | ||||||
| CAS号 | 1309-42-8 | ||||||
| 简短说明 | 白色粉末 | ||||||
| 属性 | |||||||
| 摩尔质量 | 58.33 克摩尔 | ||||||
| 物质状态 | 固定 | ||||||
| 密度 | 2.38 克厘米 | ||||||
| 熔点 | 350℃分解 | ||||||
| 溶解度 | 不溶于水和酒精,溶于铵盐溶液和稀酸(L=1 10 mol l;在25°C的水中) | ||||||
| 安全说明 | |||||||
| |||||||
| MAK | 未设置 | ||||||
| 在可能和常见的情况下,使用 SI 单位。除非另有说明,否则给出的数据适用于标准条件。 | |||||||
氢氧化镁 Mg(OH)2 是一种无定形的白色粉末。它在自然界中偶尔以矿物水镁石的形式出现。水镁石的晶格由氢氧根离子的六方密球堆积组成。每隔一个八面体间隙层被镁离子 (Mg) 占据。
属性
氢氧化镁微溶于水和碱性溶液,但易溶于酸性溶液(如盐酸、硝酸)。氢氧化镁也易溶于铵盐溶液,因为氢氧根离子被铵离子截断:
-
 。
。
氢氧化镁与酸形成碱性盐和中性盐。
在高于 350 °C 的温度下,缓慢分解成氧化镁。在 600 °C 时,平衡实际上在氧化物一侧。
获取与显示
氢氧化镁可以通过用石灰乳 (1) 沉淀从钾碱提取的残余液体中获得,或者通过用烧白云石从海水中沉淀 (2) 来获得。然后将产物过滤并在约 100°C 下干燥。特别是纯氢氧化镁是由水对元素镁(3)的作用产生的。
(1) 
(2) 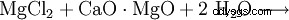
(3) 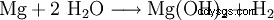
用法
工业生产的氢氧化镁大部分在500-600℃下通过煅烧(烧制)进一步加工成氧化镁。
氢氧化镁用作食用油添加剂(结合二氧化硫)、废水处理的絮凝剂、热塑性塑料(聚烯烃、PVC)和弹性体中的阻燃剂,以及洗涤剂中的添加剂。
在医学上用作抗酸剂(中和胃酸的药物)和非常强的泻药。
氢氧化镁作为酸度调节剂或脱模剂添加到食品中,在欧盟被批准为食品添加剂,E编号为E 528。
来源
- ↑ BGIA Gestis 有害物质数据库